OSSEOINTEGRAÇÃO PARTE II: COMO A RUGOSIDADE DO IMPLANTE INFLUENCIA NA ADESÃO CELULAR
Por: M.e. Eng. Lucas Kurth de Azambuja
Comentamos em nosso Post anterior sobre o que é osseointegração e seus mecanismos e que a rugosidade tem um papel fundamental da integração metal osso. Hoje vamos abordar como a rugosidade influencia no sucesso ou não da osseointegração. Para isso vamos abordar um pouco o princípio de molhabilidade e em seguida sobre a rugosidade e sua influência na adesão celular.
Molhabilidade
Um parâmetro importante a considerar na interação superficial da amostra com o osso é a molhabilidade da superfície. Moléculas orgânicas (proteínas, lipoproteínas, peptídeos) e inorgânicas (cálcio, fosfato) são prontamente atraídas do sangue para a superfície do TiO2 hidratado/hidroxilado, com alto grau de molhabilidade. Então, podem ocorrer interações eletroestáticas entre aminoácidos de carga positivas e a superfície do implante carregado negativamente ou em grupos de aminoácidos carregados negativamente com pontes de hidrogênio absorvidas pela superfície do implante previamente.
Superfícies lisas onde o ângulo de contato entre a gota e a superfície é menor que 90º, representam o cenário ótimo para adesão celular. A molhabilidade e energia livre podem ser calculados pela equação de Young, que desconsidera a rugosidade da superfície. Porém, considerando a superfície, devemos adotar um modelo que considera o ângulo de contato com da superfície incidente sobre a gota, esse modelo é conhecido como modelo de Wendel [1]. Outro modelo a ser considerado é o modelo de rugosidade de Cassier-baxter [2], o qual prevê ângulo de contato maior que 90° e espaçamento entre os vales de rugosidade muito pequenos, de modo que a gota não consegue espaço para quebrar a tensão superficial, gerando uma superfície hidrofóbica.
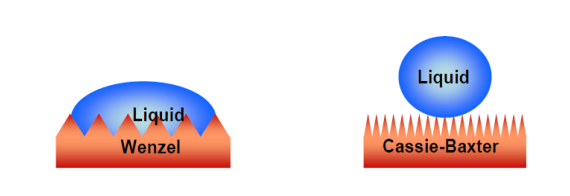
Portanto, fazendo uma ligação com a rugosidade, quanto maior a rugosidade mais dificuldade as células terão de se espalhar e aderir a superfície, no entanto uma superfície muito lisa e usinada com uma rugosidade extremamente baixa, torna a superfície hidrofóbica, ruim para adesão celular[3]
Rugosidade e a adesão celular
Segundo Cooper [4] o aumento da área das superfícies de titânio melhora o contato osso-implante e as propriedades mecânicas da interface. Em modelos de cultura celular, o aumento da superfície afeta positivamente as atividades celulares ósseas.
Maximo et al [5] explicam que a morfologia da superfície do implante afeta a biocompatibilidade do titânio e a função celular. A rugosidade altera a força de adesão celular na superfície e modifica a conexão entre ambos. Essa força de adesão pode ser modificada pela presença de diferentes células, que são mais numerosas quando a fibronectina está presente na superfície do implante. Em superfícies rugosas existe maior quantidade de proteínas séricas e fibronectina, se comparados às superfícies lisas. Essa maior adesão celular em superfícies rugosas de titânio pode ser explicada pela adsorção preferencial de fibronectina ao substrato rugoso. Sendo assim, as diferentes rugosidades influenciam na formação de células que por sua vez influenciam na osseointegração, como osteoblastos e osteoclastos.[5]

Superfície do implante. (A) detalhe da superfície do implante com uma rede de fibrinas aderida à superfície e em (B) observa-se uma extensa formação de canais de Harvers (osteons), conferindo a esta estrutura óssea uma perfeita micro-irrigação sanguínea de suporte para a chegada de nutrientes e novas células sanguíneas. Fonte: Zanivan, Dênis S., et al. “Análise da superfície de fratura de implante osseointegrado e mecanismos envolvidos na cicatrização.” Revista ImplantNews 6.1 (2009): 39-46.
Tendo isso em vista, Linez-Bataillon et al [6] entendem que a rugosidade deve ser controlada, pois as células necessitam de pontos de ancoragem, na superfície dos implantes, para iniciar a proliferação e constituir a biofixação dos implantes. Se as rugosidades forem muito menores que o tamanho das células, não existirão sítios de biofixação adequados. Em contrapartida, se a superfície apresentar grandes picos ou vales, mas se estes possuírem superfícies demasiadamente lisas, as células poderão também não encontrar sítios de biofixação adequados.

Pontes fibrosas mineralizadas aderidas na superfície do implante removido. Fonte: Zanivan, Dênis S., et al. “Análise da superfície de fratura de implante osseointegrado e mecanismos envolvidos na cicatrização.” Revista ImplantNews 6.1 (2009): 39-46.
Ainda segundo Teughels et al.[7], existem numerosas classificações para as superfícies dos implantes que levam em consideração os mais diversos aspectos. Quanto as rugosidades superficiais são categorizadas em: minimamente rugosa (0.5-1 μm), medianamente rugosa (1-2 μm) e rugosa (2-3 μm), considerando-se lisa como sendo < 0.5 μm.

Análise em microscópio eletrônico de varredura (MEV) das superfícies dos quatro implantes ampliadas 100X: A – Lisa-Ti, B – Alumina-Ti, C – SLA, D – BCP-Ti .Fonte: “The effect of titanium-implant surfaces on the behaviour and characteristics of osteoblastos”
Em estudos conduzidos por Rosa e al[8]. Foram testados implantes de Titânio com diferentes rugosidades a fim de testar diferentes respostas a diferentes rugosidades. Foi analisado: fixação celular, proliferação celular, atividade da fosfatase alcalina, teor de proteína e formação de nódulos ósseos. Testou-se superfícies jateadas com partículas de alumina (AL2O3) de diferentes tamanhos gerando superfícies com diferentes rugosidades: Ti-lisa 0.24 µm, Ti-25 = 0.69 µm, Ti-75 = 0.83 µm, and Ti-250 = 1.91 µm.
Os resultados apontados por Rosa et al. Indicam uma redução da proliferação celular, do teor de proteína atividade da fosfatase alcalina, com o grande aumento da rugosidade, porém contatou-se diferenças estatísticas na fixação celular e na criação de nódulos ósseos.
O estudo sugeriu que uma rugosidade de 0.8 a 1.9 µm para Titânio otimizariam a resposta celular, porém não influenciam na fixação celular.
Continuação
No próximo e último post sobre osseointegração, vamos falar como é feita a medida da rugosidade e como isso está sendo usado em diferentes desenvolvimentos tecnológicos de implantes.
Sobre o Autor

M.e. Eng. Lucas Kurth de Azambuja
Lucas Kurth de Azambuja é Mestre e Engenheiro de Materiais, formado pela UFSC, especializado na área de polímeros. Também realizou intercâmbio para França na École Nationale d’ingénieurs de Saint-Étienne e estagiou na École de Mines de Saint Étinne. Desde 2017, Lucas é bolsista no Laboratório de Engenharia Biomecânica, onde realizou seu trabalho de conclusão de curso focado no estudo de degradação de implantes mamários. Posteriormente realizou sua dissertação, também no laboratório, focado na análise de insertos acetabulares após uso em in vivo. Hoje é resposável pela execução das análises poliméricas do laboratório, além de colaborar no projeto do Centro Nacional de Explantes.
Veja outros conteúdos elaborados pelo autor
OSSEOINTEGRAÇÃO: HISTÓRIA, FUNDAMENTOS E EFEITOS DE INTERFACE
Como os implantes de joelho evoluíram?
Qual a importância da Engenharia Biomecânica?
Referências
[1] H. P. Wendel, N. Weber, and G. Ziemer, “Increased adsorption of high molecular weight kininogen to heparin-coated artificial surfaces and correlation to hemocompatibility,” Immunopharmacology, vol. 43, no. 2–3, pp. 149–153, 1999, doi: 10.1016/S0162-3109(99)00073-9.
[2] A. B. D. Cassie and S. Baxter, “Wettability of porous surfaces,” Trans. Faraday Soc., vol. 40, no. 0, pp. 546–551, Jan. 1944, doi: 10.1039/tf9444000546.
[3] F. L. e Silva, F. Rodrigues, S. Pamato, and J. R. Pereira, “Tratamento de superfície em implantes dentários: uma revisão de literatura,” RFO UPF, 2016. http://revodonto.bvsalud.org/scielo.php?script=sci_arttext&pid=S1413-40122016000100021 (accessed May 17, 2021).
[4] L. F. Cooper, “A role for surface topography in creating and maintaining bone at titanium endosseous implants,” J. Am. Dent. Assoc., vol. 132, no. 10, p. 1452, 2001, doi: 10.14219/jada.archive.2001.0062.
[5] F. S. Maximo, C. N. Elias, D. J. Fernandes, F. de O. Monteiro, and J. Cavalcanti, “Análise da superfície e osseointegração de implantes dentários com superfícies biomiméticas contedo Ca, Mg e F,” Rev. Mater., vol. 21, no. 1, pp. 196–203, Jan. 2016, doi: 10.1590/S1517-707620160001.0017.
[6] P. Linez-Bataillon, F. Monchau, M. Bigerelle, and H. F. Hildebrand, “In vitro MC3T3 osteoblast adhesion with respect to surface roughness of Ti6Al4V substrates,” in Biomolecular Engineering, 2002, vol. 19, no. 2–6, pp. 133–141, doi: 10.1016/S1389-0344(02)00024-2.
[7] W. Teughels, N. Van Assche, I. Sliepen, and M. Quirynen, “Effect of material characteristics and/or surface topography on biofilm development,” Clin. Oral Implants Res., vol. 17, no. SUPPL. 2, pp. 68–81, Oct. 2006, doi: 10.1111/j.1600-0501.2006.01353.x.
[8] A. L. Rosa and M. M. Beloti, “Effect of cpTi surface roughness on human bone marrow cell attachment, proliferation, and differentiation.,” Braz. Dent. J., vol. 14, no. 1, pp. 16–21, 2003, doi: 10.1590/S0103-64402003000100003.






