OSSEOINTEGRAÇÃO PARTE I: HISTÓRIA, FUNDAMENTOS E EFEITOS DE INTERFACE
Por: M.e. Eng. Lucas Kurth de Azambuja
O que é osseointegração?
Osseointegração é definida como a conexão direta estrutural e funcional entre o osso vivo e a superfície de um implante de suporte de carga. A capacidade de um implante de se ligar ao osso hospedeiro circundante é um requisito fundamental para implantes ortopédicos permanentes fixados sem cimento ósseo (cementless) [1].

Integração osso e implante. Fonte: https://atmodontologia.com.br/implantes.html
Um pouco de história
Inicialmente em 1940 Bothe, Beaton e Davenport [2] foram os primeiros a perceber a tendência de fusão titânio-osso, através de implantes em animais.
Mais tarde, em 1951, Leventhal [3]] propôs um mecanismo de osseointegração implantado um parafuso no fêmur de um rato e constatou que segundo seus relatos : “em 6 semanas o parafuso estava mais resistente a tração que no dia que foi implantado, 12 semanas estava mais rígido que em 6 semanas e em 16 semanas a força para retirada do parafuso acabou por faturar o fêmur do rato”.
Em 1952 Branemark[1] cunha o termo osseointegração, através de experimentos com animas. Porém, durante 30 anos, o mesmo tentou convencer a sociedade cientifica que o tratamento era viável em humanos até que em 1983, através dos resultados de estudos realizados por George Zarb[4], o trabalho de Branemark é reconhecido mundialmente no campo de implantes metálicos. Hoje o mecanismo de osseointegração é bem conhecido e utilizado principalmente na área de implantes odontológicos e na área de implantes ortopédicos.
Mecânismo de osseointegração mecânica
A osseointegração após a inserção de um implante acontece em três fases: osteofílica, osteocondutiva e fase osseoadaptativa, descritas de forma sucinta a seguir:
Osteofílica
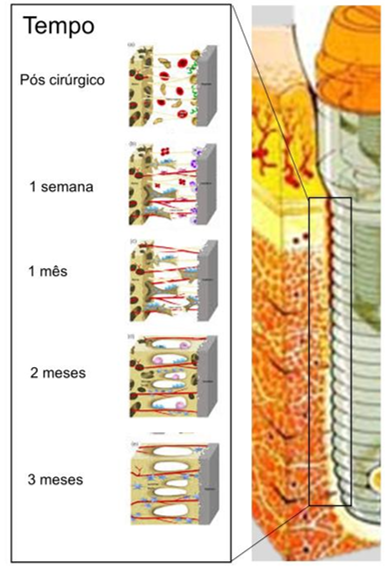
Adaptada de: http://www.360oandp.com/Technology-Osseointegration.aspx
Primeiramente o implante é colocado no espaço entre a medula esponjosa, o sangue está inicialmente presente entre o implante e o osso, sendo que apenas uma pequena quantidade de osso está em contato com a superfície do implante, as demais partes são expostas a fluidos extracelulares. Imediatamente, inicia-se uma resposta inflamatória generalizada em torno do implante devido ao estímulo cirúrgico. Na primeira semana, as células inflamatórias respondem a antígenos estranhos, sendo que o crescimento vascular dos tecidos vitais circundantes começa pelo terceiro dia. A ossificação também começa durante a primeira semana e a resposta inicial observada na migração de osteoblastos do osso trabecular (tecido ósseo esponjoso) que pode ser devido à liberação de BMP’s (proteínas morfogenéticas ósseas). Após três semanas, uma rede vascular madura estará formada e a fase osteofilica estará completa por volta de um mês[5].
Osteocondutiva
As células ósseas, uma vez que atingem o implante, espalham-se pela superfície metálica que estabelece o osteóide. Inicialmente, esta é uma matriz de tecido conjuntivo imaturo e o depósito ósseo é uma fina camada de osso tecido chamado “foot plate”. O calo fibro-cartilaginoso é eventualmente remodelado em calo ósseo. Após três à quatro meses a superfície do implante está inteiramente recoberta com tecido ósseo[5].
Osseoadaptativa
Uma vez o iplante calcificado, o mesmo não ganha ou perde contato ósseo, mas os “foot plates” se prendem devido a uma reorientação do padrão vascular. O osso enxertado integra-se em maior grau do que o osso hospedeiro natural ao implante. Para obter resultados ótimos, um período de osseointegração de 4 meses foi recomendado para implantes colocados com enxerto, e de 4 a 8 meses para implantes colocados no osso normal[5].
Efeitos de interface

Diferentes rugosidades para superfícies de titânio Fonte: Sartoretto, Suelen Cristina, et al. “Early osseointegration driven by the surface chemistry and wettability of dental implants.” Journal of applied oral science 23.3 (2015): 279-287.
Em 1981, Schroeder [6] realizou um estudo de crescimento ósseo ao redor do implante em diversas superfícies implantadas em primatas. Os resultados demonstraram um crescimento ósseo maior na superfície rugosas formando uma “anquilose” junto ao metal. Cinco ano mais tarde, em 1986, Maniatopoulos, Pilliar e Smith[7] compararam a fixação dos ossos em implantes industrializados cilíndricos lisos, com roscas com superfícies lisas e roscas com superfícies porosas. Os autores relataram uma força interfacial maior para implantes com superfícies porosas em relação aos de superfícies lisas..
Wennerberg, Albrektsson e Lausamaa [8], em 1996, compararam o torque de remoção de implantes e a histomorfometria de implantes jateados com 25 µm de Al2O3 e implantes jateados por partículas de 75 µm de Al2O3. Além de um torque de remoção maior, houve um maior contato osso-implante nas superfícies jateadas com 75 µm Al2O3 (24,5% de osso em contato com implante contra 17,6% nas superfícies jateadas com 25µm). No mesmo ano, Wennerbeg et al. compararam três superfícies diferentes de implantes durante um ano, uma usinada e considerada lisa, outra jateada com partículas de 25µm de Al2O3 e outra jateada com partículas de 250 µm também de Al2O3. Os implantes com superfície lisa apresentaram valor de Sa (Ra em valores 3D) de 0,4 enquanto os jateados com partículas de 25 µm obtiveram um valor de Sa de 1,16 e os jateados com 250 µm Sa de 1,94. As duas superfícies jateadas apresentaram maior torque de remoção do que a superfície usinada. A análise histológica apresentou maior contato osso/implante nas superfícies jateadas com um ano de seguimento.
Posteriormente em 1998, Wennerber, Hallgren e Danelli et al [9] compararam histologicamente superfícies polidas a outras três diferentes superfícies jateadas. Após 12 meses de implantação em tíbias de cobaias, as superfícies jateadas mostraram quantidade de contato ósseo superior, e entre elas, as jateadas com partículas de 75 µm se destacou.
Em 2004, Wennerberg et al [10], classificaram a rugosidade da superfície da seguinte maneira: os implantes lisos possuem uma rugosidade (parâmetro de Ra) inferior a 0,5 μm; os implantes minimamente rugosos possuem Ra entre 0,5 e 1,0 μm; os implantes moderadamente rugosos possuem Ra variando de1,0 a 2,0 μm e os implantes rugosos são aquelas que possuem um Ra acima de 2,0 μm.
Continuação
Se você gostou do conteúdo e se interessa por mais assuntos relacionados a engenharia biomecânica, acesse nosso blog. Semana que vem vamos continuar o assunto sobre osseointegração comentando sobre os efeitos de molhabilidade e rugosidade para a adesão celular
Sobre o autor

M.e. Eng. Lucas Kurth de Azambuja
Lucas Kurth de Azambuja é Mestre e Engenheiro de Materiais, formado pela UFSC, especializado na área de polímeros. Também realizou intercâmbio para França na École Nationale d’ingénieurs de Saint-Étienne e estagiou na École de Mines de Saint Étinne. Desde 2017, Lucas é bolsista no Laboratório de Engenharia Biomecânica, onde realizou seu trabalho de conclusão de curso focado no estudo de degradação de implantes mamários. Posteriormente realizou sua dissertação, também no laboratório, focado na análise de insertos acetabulares após uso em in vivo. Hoje é resposável pela execução das análises poliméricas do laboratório, além de colaborar no projeto do Centro Nacional de Explantes.
Referências
[1] P. I. Branemark, “Osseointegration and its experimental background,” J. Prosthet. Dent., vol. 50, no. 3, pp. 399–410, 1983, doi: 10.1016/S0022-3913(83)80101-2.
[2] R. T. Bothe, L. E. Beaton, and H. A. Davenport, “Reaction of Bone to Multiple Metallic Implants. References – Scientific Research Publishing,” Scientific Research Publishing, 1940. https://www.scirp.org/(S(lz5mqp453edsnp55rrgjct55))/reference/ReferencesPapers.aspx?ReferenceID=1106890 (accessed May 17, 2021).
[3] G. Leventhal, “TITANIUM, A METAL FOR SURGERY,” JBJS, 1951. https://journals.lww.com/jbjsjournal/abstract/1951/33020/titanium,_a_metal_for_surgery.21.aspx (accessed May 17, 2021).
[4] E. Mcclarence, “Close To The Edge: Branemark And The Development Of Osseointegration,” undefined, 2003.
[5] R. S. Jayesh and V. Dhinakarsamy, “Osseointegration.,” J. Pharm. Bioallied Sci., vol. 7, no. Suppl 1, pp. S226-9, 2015, doi: 10.4103/0975-7406.155917.
[6] A. Schroeder, E. van der Zypen, H. Stich, and F. Sutter, “The reactions of bone, connective tissue, and epithelium to endosteal implants with titanium-sprayed surfaces,” J. Maxillofac. Surg., vol. 9, no. C, pp. 15–25, Feb. 1981, doi: 10.1016/S0301-0503(81)80007-0.
[7] R. M. Pilliar, J. M. Lee, and C. D. D. S. Maniatopoulos, “Observations on the effect of movement on bone ingrowth into porous-surfaced implants,” Clinical orthopaedics and related research, 1986. https://pubmed.ncbi.nlm.nih.gov/3720113/ (accessed May 17, 2021).
[8] A. Wennerberg, T. Albrektsson, C. Johansson, and B. Andersson, “Experimental study of turned and grit-blasted screw-shaped implants with special emphasis on effects of blasting material and surface topography,” Biomaterials, vol. 17, no. 1, pp. 15–22, 1996, doi: 10.1016/0142-9612(96)80750-2.
[9] A. Wennerberg, C. Hallgren, and S. Danelli, “A histomorphometric evaluation of screw‐shaped implants each prepared with two surface roughnesses,” Clinical oral implants research. pp. 11–19, 1998.
[10] A. Wennerberg et al., “Titanium release from implants prepared with different surface roughness: An in vitro and in vivo study,” Clin. Oral Implants Res., vol. 15, no. 5, pp. 505–512, 2004, doi: 10.1111/j.1600-0501.2004.01053.x.






